Лаборатория лучевой терапии
Заведующий лабораторией

Минайло Ирина
Ивановна
Основные направления деятельности
- обеспечение качественного лучевого лечения;
- проведение фундаментальных, прикладных и поисковых исследований, выявление новых возможностей и внедрение в практическое здравоохранение наиболее эффективных методов лучевой терапии злокачественных новообразований;
- разработка и внедрение в практическое зравоохранение новых методов профилактики и лечения постлучевых реакций и осложнений;
- разработка и внедрение программы гарантии качества лучевой терапии;
- изучение достижений отечественной и зарубежной науки в области радиационной онкологии (лучевой терапии) и подготовка предложений об их практическом использовании, своевременности и правильности их внедрения;
- подготовка кадров по лучевой терапии в клинической ординатуре, аспирантуре и докторантуре, а также через систему последипломной подготовки;
- осуществление методической и лечебно-консультативной помощи по вопросам обследования и лечения, а также методического руководства службой лучевой терапии в Республике Беларусь.
Научный, клинический и технический персонал группы лучевой терапии прошел обучение в лучших зарубежных центрах США, Швейцарии, Франции, Дании, Латвии, Германии, Голландии, а также на обучающих курсах Европейского Общества Радиационных Онкологов (ESTRO).
Лучевая терапия проводится с использованием самого современного радиотерапевтического оборудования, в состав которого входят:
- Линейные ускорители электронов "Clinac 2300C/D", "Trilogy", "Unique", "TrueBeam" с энергией фотонов 6 и 18 МВ и энергией электронов 4, 6, 9, 12, 16 и 20 МэВ, с компьютерной системой управления, с динамической многопластинчатой диафрагмой Millennium MLC и пакетом программ, позволяющим реализовать самые современные методики облучения (отображения в реальном времени "PortalVision", управления и верификации лучевой терапии "VARIS", синхронизации работы ускорителя с фазами дыхания пациентов "RPM RespiratoryGating", реализации облучения с модулированной интенсивностью (IMRT) и модулированной арк-терапией (IMAT).

Линейный ускоритель "Trilogy"

Система планирования лучевой терапии
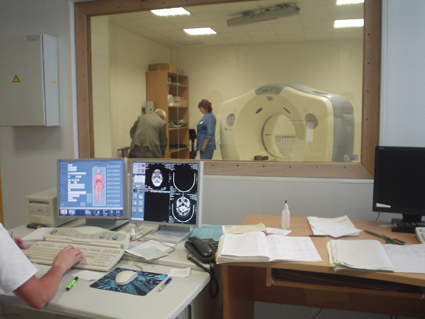
Компьютерный томограф для планирования лучевой терапии
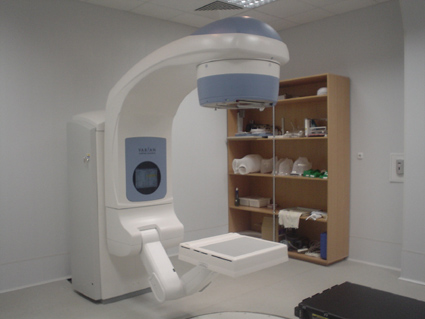
Рентгеновский симулятор для планирования лучевой терапии
Дозиметрическое сопровождение и технический контроль качества лучевой терапии в Центре осуществляется на самом современном уровне с соблюдением всех международных стандартов, что подтверждено неоднократными инспекциями экспертов Международного Агентства по Атомной Энергии (МАГАТЭ).
Стереотаксическая радиохирургия на аппарате «Гамма-нож»
Стереотаксическая радиохирургия опухолей головного мозга – это подведение большой дозы излучения к мишени за одну фракцию (сеанс). Несмотря на свое название, стереотаксическая радиотерапия не является хирургической процедурой. Методика подразумевает высокоточную доставку к опухоли большой дозы ионизирующего излучения в обход рядом расположенных здоровых тканей.
Радиохирургическое лечение представляют собой важную альтернативу открытым хирургическим вмешательствам, особенно для пациентов, которые не в состоянии перенести операцию. Стереотаксическое облучение возможно также при опухолях, которые находятся рядом с жизненно важными отделами головного мозга или в труднодоступных для хирурга местах.
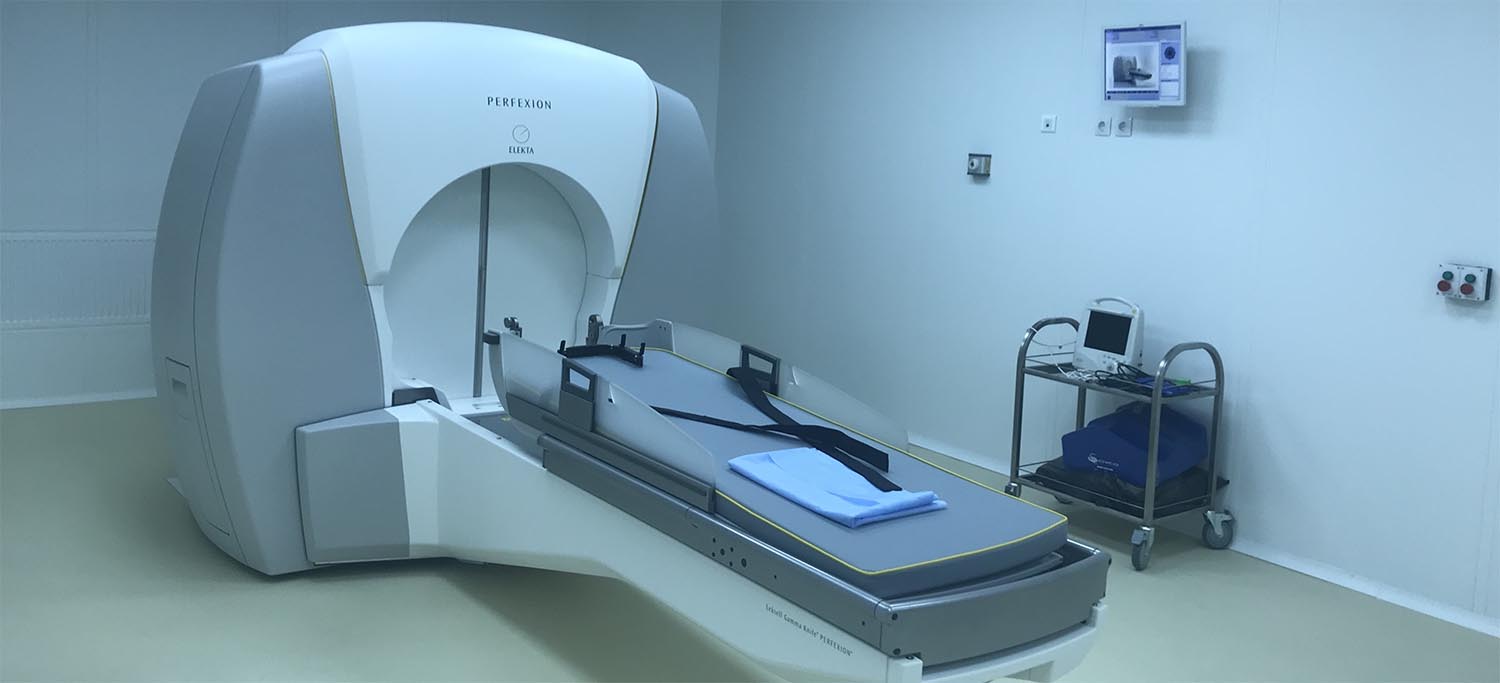
В настоящее время во всем мире насчитывается более 350 аппаратов «Гамма-нож», лечение по данной технологии получили, по некоторым оценкам, более 1 000 000 пациентов.
В РНПЦ ОМР им. Н.Н. Александрова радиохирургия проводится на самом современном радиотерапевтическом комплексе «Leksell Gamma Knife Perfexion» (Elekta), установленном в 2017 году.
Процедура выполняется под местной анестезией, возможно поведения лечения как в стационарных, так и в амбулаторных условиях в течение одного рабочего дня.
Сеанс радиохирургии состоит из 4 этапов:
- Фиксация навигационной рамы – осуществляется под местной анестезией и не сопровождается выраженными болевыми ощущениями.
- Выполнение навигационной магнитно-резонансной томографии (при необходимости – компьютерной томографии или прямой ангиографии).
- Планирование облучения.
- Сеанс радиохирургии на аппарате «Leksell Gamma Knife Perfexion» (Elekta), длительность которого может варьировать от десятков минут до нескольких часов в зависимости от сложности случая.
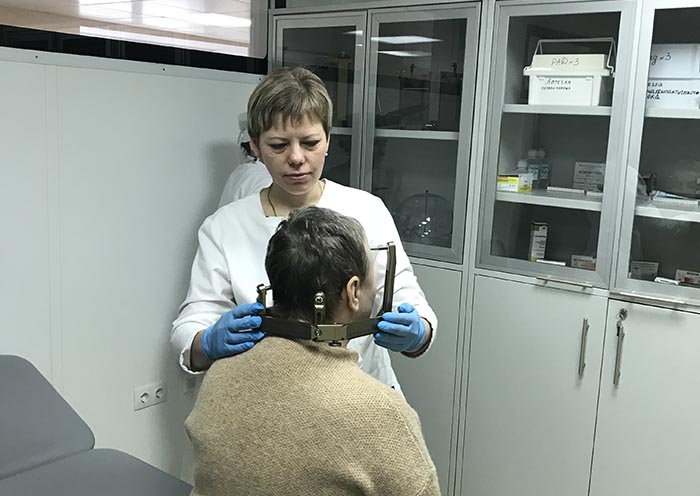
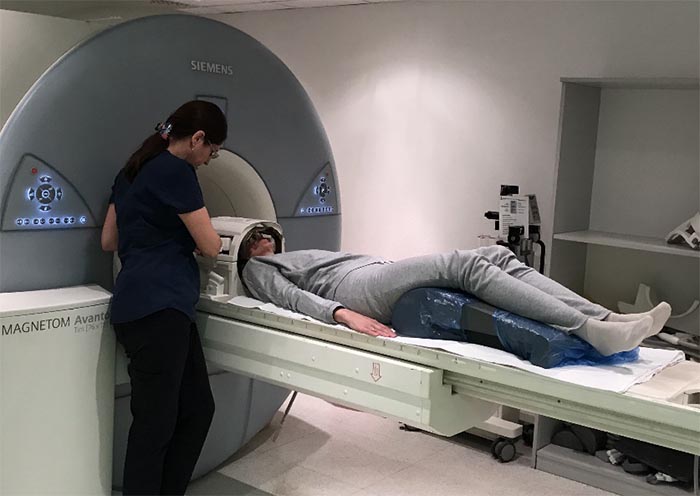
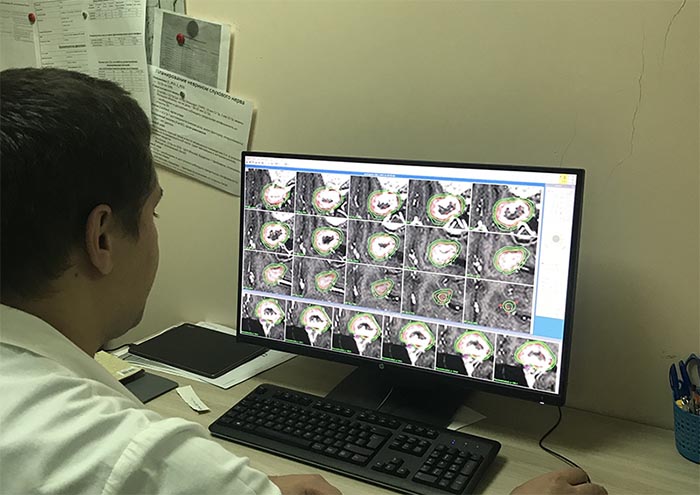
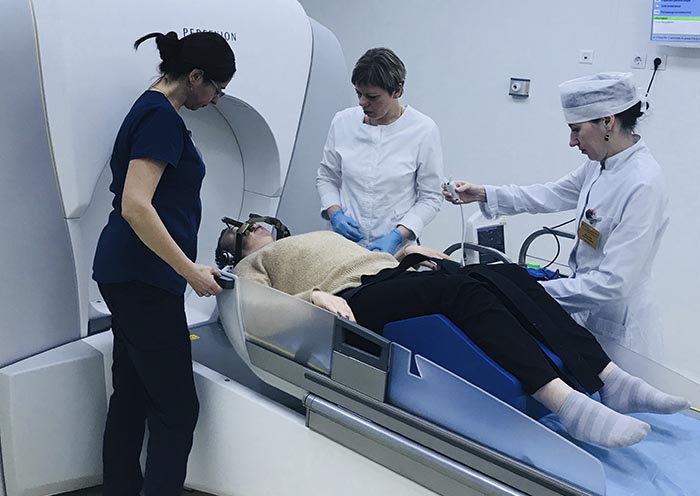
Процедура проводиться командой специалистов, в состав которой входят высококвалифицированные врачи-радиационные онкологи, рентгенологи и медицинские физики.
Показаниями к проведению радиохирургии на аппарате «Гамма-нож» являются:
- метастатическое поражение головного мозга (размер новообразования не более 3 см в наибольшем измерении, общее количество до 10, общее состояние пациента по шкале Карновского не менее 70%);
- невриномы черепно-мозговых нервов (не более 3 см в наибольшем измерении);
- менингиомы (не более 3 см в наибольшем измерении);
- аденомы гипофиза (не более 3 см в наибольшем измерении);
- артерио-венозные мальформации;
- краниофарингиомы;
- каверномы;
- пинеаломы;
- рецидивы злокачественных глиом головного мозга после проведенного ранее специального лечения (не более 3 см в наибольшем измерении).
Лучевая терапия проводится с использованием наиболее современных методик облучения:
- 3D конформная лучевая терапия с использованием объемного планирования;
- лучевая терапия с модуляцией интенсивности дозы (IMRT);
- модулированная по интенсивности арк-терапия (VMAT);
- стереотаксическая интра- и экстракраниальная радиохирургия/терапия (SRS/SRT);
- четырехмерная конформная лучевая терапия;
- брахитерапия опухолей предстательной железы с высокой мощностью дозы под контролем ТРУЗИ и планированием в реальном времени;
- брахитерапия с использованием интегрированного рентгено-топометрического комплекса (IBU) под анестезиологическим пособием.
Методики лучевой терапии
Трехмерная конформная лучевая терапия
Трехмерная конформная лучевая терапия предусматривает придание объему высокой дозы формы опухоли, ограничивая при этом до минимума дозу на окружающие здоровые ткани.
С клинической точки зрения – это попытка обеспечить полное излечение первичного очага без превышения толерантности нормальных тканей.
Данная методика используется при лечении больных с заболеваниями ЦНС, орбиты, лицевого черепа, грудной полости, брюшной полости, малого таза и злокачественными лимфомами, подлежащих лучевой терапии по радикальной программе и нуждающихся в использовании трехмерного (объемного) планирования для обеспечения максимального снижения лучевой нагрузки на критические органы и ткани.
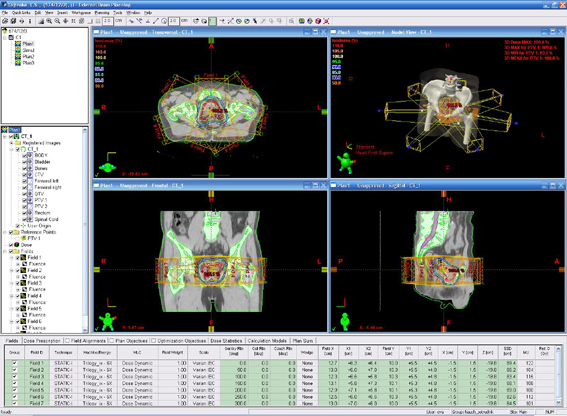
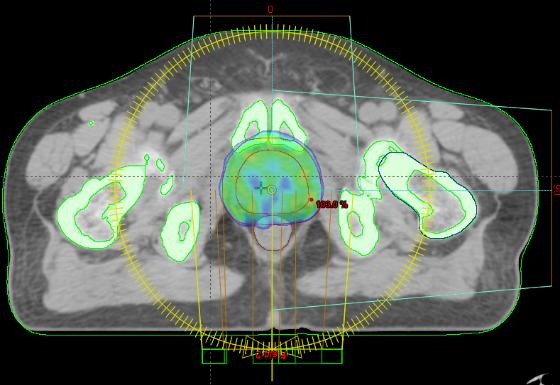
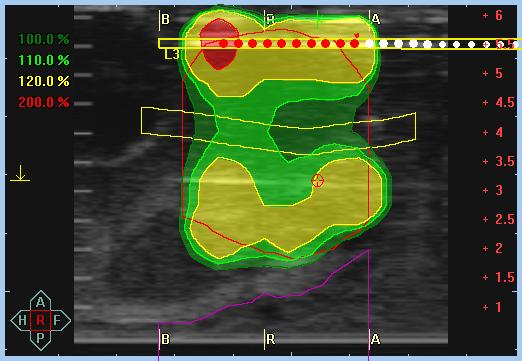
Мишень облучения, критические органы, дозное распределение и поля облучения при облучении предстательной железы
Интенсивно-модулированная радиотерапия (IMRT)
Интенсивно-модулированная радиотерапия – технология дистанционного облучения, позволяющая еще больше снизить лучевые нагрузки на здоровые ткани и критические органы. Она дает возможность создавать не только радиационное поле любой требуемой формы, но и осуществлять облучение во время одного и того же сеанса с различной интенсивностью.
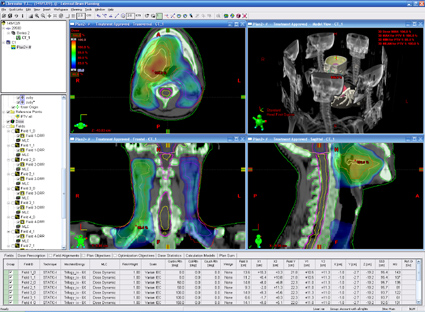
Дозовое распределение сложной формы, позволяющее снизить облучение спинного мозга и подвести различную дозу облучения к опухоли ротоглотки и регионарным лимфоузлам
Четырехмерная конформная лучевая терапия
Четырехмерная конформная лучевая терапия – методика, при использовании которой, помимо геометрических параметров опухоли в трех измерениях, учитывается "четвертое измерение", т.е. смещение опухоли во время физиологического акта дыхания.
Данная методика обеспечивает более точное подведение лечебной дозы к подвижным опухолям, позволяет значительно снижать лучевую нагрузку на здоровые органы и ткани за счет уменьшения отступа, добавляемого к клиническому объему мишени, а также делает возможным проведение увеличения дозы облучения опухоли.
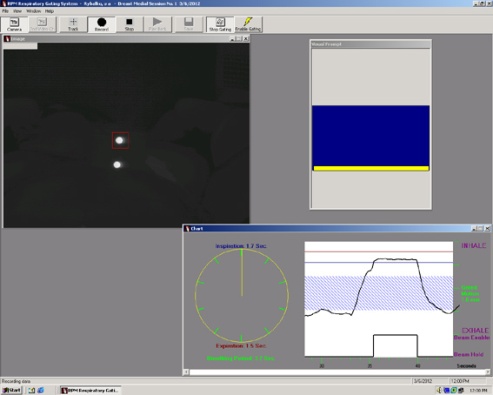
Маркер движения грудной клетки при дыхании, при выходе которого за рамки установленного диапазона облучение автоматически прекращается
Модулированная по интенсивности арк-терапия (VMAT)
Это комплексная методика ротационного динамического облучения, где при помощи объемной модуляции интенсивности фотонного излучения за один полный оборот штатива линейного ускорителя градусов в мишень точно доставляется запланированное суммарное индивидуальное распределение дозы.
Для получения заданного распределения дозы в процессе облучения происходит постоянное движение множества лепестков коллиматора, изменяющих размеры и форму поля облучения, а также варьирующееся комплексное дозовое распределение, доставляющее по всему объему мишени внутри тела пациента за счет изменения скорости вращения штатива и мощности поглощенной дозы.
Данная методика позволяет получить более конформное дозовое распределение, уменьшить лучевую нагрузку на здоровые ткани и критические органы. Сеансы лучевой терапии сопровождаются меньшим количеством мониторных единиц, что способствует сокращению часа пребывания пациента на лечебном столе линейного ускорителя электронов.
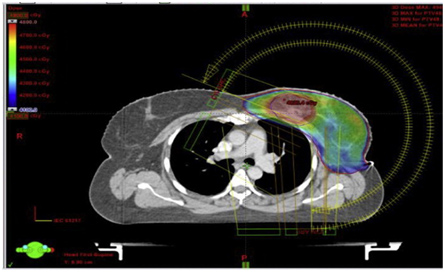
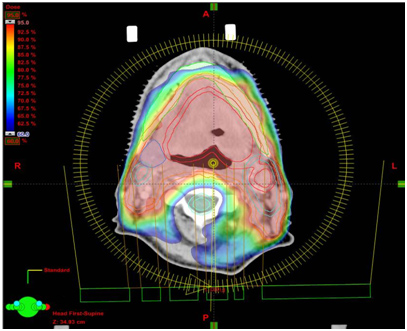
Мишень облучения, критические органы, дозовое распределение и поля облучения при использовании методики VMAT
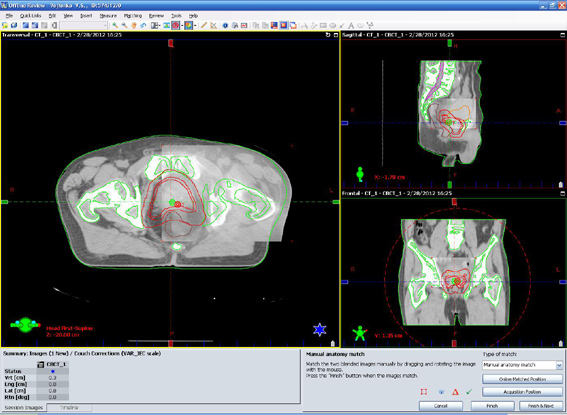
Совмещение изображений при IGRT
Точность выполнения плана лечения от сеанса до сеанса облучения обеспечивается лучевой терапией, управляемой по изображению в режиме реального времени (IGRT - ImageGuidedRadiotherapy) и использованием фиксирующих приспособлений. IGRT технология использует сравнение КТ-изображений, полученных в позиции облучения непосредственно на линейном ускорителе с КТ-изображениями, полученными в процессе предварительной подготовки, для коррекции положения пациента во время сеансов облучения.
Лучевая терапия – метод лечения, предусматривающий применение ионизирующего излучения для лечения злокачественных новообразований, а также некоторых неопухолевых заболеваний.
Лучевая терапия применяется практически при любой стадии заболевания. Так, у оперируемых пациентов в качестве компонента комбинированного лечения, у неоперируемых – как самостоятельный метод либо как компонент комплексного лечения, а также в качестве паллиативного и симптоматического средства в тех случаях, когда другие специальные методы лечения оказываются неприемлемыми или неэффективными.
Лечение проводится на гамма-терапевтических аппаратах и линейных ускорителях электронов.
Для того чтобы лучевая терапия была высокоэффективной, помимо специальных знаний о радиобиологии опухолей, точном выборе ежедневной и суммарной дозы облучения, времени ее подведения, практически важно полностью обеспечить облучение опухоли (какой бы сложной объемной конфигурацией она не обладала), при этом минимально воздействуя на близлежащие здоровые ткани.
Решение этой стратегически важной задачи, предполагающей так называемое конформное облучение, возможно только с помощью современных технологий лучевой терапии, которые дают возможность наиболее точного подведения лечебной дозы к опухоли, так как при планировании учитывается пространственная геометрия новообразования.
К современным конформным методикам лучевой терапии относятся:
- трехмерная конформная лучевая терапия;
- лучевая терапия с модуляцией интенсивности дозы;
- стереотаксическая радиохирургия/лучевая терапия;
- четырехмерная конформная лучевая терапия.
Трехмерная конформная лучевая терапия с клинической точки зрения – это попытка обеспечить полное излечение первичного очага без превышения толерантности нормальных тканей.
Данная методика используется при лечении пациентов с заболеваниями ЦНС, орбиты, лицевого черепа, грудной полости, брюшной полости, малого таза и злокачественными лимфомами I-III стадии, подлежащих лучевой терапии по радикальной программе и нуждающихся в использовании трехмерного (объемного) планирования для обеспечения максимального снижения лучевой нагрузки на критические органы и ткани.
Стереотаксическая радиохирургия/лучевая терапия – еще одна современная методология лучевой терапии.
Основное отличие между ними в способе фракционирования дозы.
При радиохирургии подводится одна крупная фракция (доза 15-20 гр.), при стереотаксической лучевой терапии – фракционированное облучение (две фракции и более).
Стереотаксическая радиохирургия используется свыше 30 лет для лечения доброкачественных и злокачественных опухолей, сосудистых мальформаций и других заболеваний мозга.
К настоящему моменту более 100 000 пациентов по всему миру подверглись подобной терапии.
Четырехмерная конформная лучевая терапия – методика, при использовании которой, помимо геометрических параметров опухоли в трех измерениях, учитывается "четвертое измерение", т.е. смещение опухоли во время физиологического акта дыхания.
Данная методика обеспечивает более точное подведение лечебной дозы к подвижным опухолям, позволяет значительно снижать лучевую нагрузку на здоровые органы и ткани.
Сотрудники
Набор фиксирующих принадлежностей
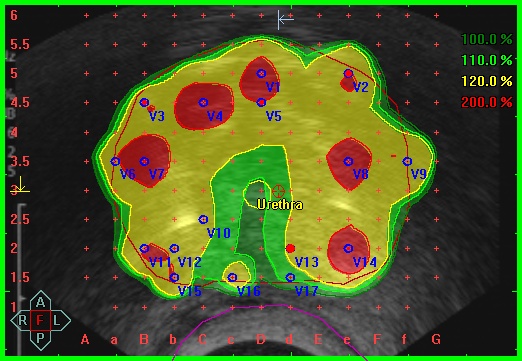
Дозное распределение при проведении брахитерапии рака предстательной железы под ультразвуковым контролем
Исследования
Разработаны следующие методы лучевой терапии:
- поэтапной смены режимов (укрупненного и традиционного) фракционирования дозы;
- динамического мультифракционирования с применением метода поэтапной смены режимов фракционирования дозы облучения, расщепления дневной дозы и малой "сенсибилизирующей" дозы;
- паллиативной лучевой терапии местно-распространенных первичных опухолей легких с применением нетрадиционных режимов укрупненного и крупного фракционирования дозы;
- паллиативной крупнофракционной (в т.ч. субтотальной и тотальной) лучевой терапии одиночных и множественных метастазов в костях, головном мозгу, легких, печени;
- контроля качества гамма-терапевтических аппаратов для дистанционной лучевой терапии, медицинских ускорителей электронов, компьютерных систем планирования облучения;
- измерения поглощенных доз: фотонов с энергией выше 1 МВ, ниже 0,3 МВ, электронов с энергией выше 4 МэВ и фотонов, применяемых в контактной лучевой терапии оценки эффективных доз для рентгенодиагностических исследований предлучевой подготовки с использованием объемного планирования;
- сочетанная лучевая терапия с гипофракционированием дозы излучения у пациентов, страдающих раком предстательной железы с неблагоприятным прогнозом;
- химиолучевое лечение c использованием симультанного буста и модуляции дозы излучения при орофарингеальном раке;
- метод комплексной терапии у пациентов с биохимическим рецидивом рака предстательной железы после радикальной простатэктомии;
- методика адаптивной брахитерапиирака шейки матки.
История развития отечественной лучевой терапии
Историю развития отечественной службы лучевой терапии условно можно разделить на следующие этапы:
- Первый этап (до 1960 г.) – широкое применение аппаратов дистанционной рентгенотерапии, традиционных режимов фракционирования дозы при осуществлении расчета в рентгенах по величине поверхностной дозы.
- Второй этап (1960–1967 гг.) – становление мегавольтной радиотерапии: переход на расчет очаговой поглощенной дозы, оснащение онкологических учреждений телегамма-установками (1,25 МэВ), запуск двух высоко-энергетических ускорителей: первого отечественного ускорителя с граничной энергией электронов 25 МэВ (ЛУЭ-25) и бетатрона фирмы “Siemens” с граничной энергией электронов 42 МэВ.
- Третий этап (1967–1972 гг.) – накопление опыта с применением традиционных вариантов фракционирования дозы во времени дистанционной мегавольтной лучевой терапии, что нашло отражение в докторской диссертации И.Г. Жакова, в кандидатских диссертациях Н.И. Крутилиной, Н.Е. Кругловой.
- Четвертый этап (с 1972 по 2005 гг.) – знаменует собой новый подход к решению главной проблемы лучевой терапии – расширения радиотерапевтического интервала – путем разработки нетрадиционных режимов фракционирования дозы во времени. Выполненные научные разработки оригинальных методов лучевой терапии больных, не подлежащих хирургическому лечению, основанные на новых радиобиологических знаниях.
В результате разработаны и внедрены в клиническую практику:
- метод поэтапной смены режимов (укрупненного или крупного и традиционного фракционирования дозы (докторская диссертация Муравской Г.В.). Этот метод был применен впервые в РБ и у пациентов, страдающих раком легкого, у которых лечение ранее ограничивалось только торакотомией (кандидатская диссертация Артемовой Н.А.);
- метод динамического мультифракционирования с применением метода поэтапной смены режимов фракционирования дозы облучения, расщепления дневной дозы и малой "сенсибилизирующей" дозы (кандидатская диссертация Минайло И.И.);
- метод интенсивной химиолучевой терапии неоперируемых пациентов мелкоклеточным раком легкого (кандидатская диссертация Улицкого П.И.);
- метод динамического мультифракционирования в лучевом лечении пациентов с лимфомой Ходжкина (докторская диссертация Н.И. Крутилиной);
- метод динамического мультифракционирования в химиолучевом лечении пациентов с лимфомой Ходжкина (кандидатская диссертация Моисеевой О.И.).
В направлении профилактики и лечения лучевых реакций и повреждений под руководством профессора Г.В. Муравской созданы оригинальные методы (защищенные авторскими свидетельствами и патентами) профилактики и коррекции нарушений кроветворения, развившихся в процессе лучевой и химиолучевой терапии (кандидатская диссертация Синайко В.В.), а также методы профилактики и лечения постлучевых пульмонитов (кандидатская диссертация Суравикиной В.В.).
Разработанные методы обеспечили существенное снижение частоты и тяжести развития нежелательных побочных эффектов противоопухолевого лечения.
Группой физико-технического сопровождения лучевой терапии были разработаны принципы и технические решения динамической лучевой терапии с изменяющимися параметрами облучения (докторская диссертация Тарутина И.Г.), (кандидатские диссертации Пилявца В.И., Страха А.Г., Миненко В.Ф.).
За цикл работ "Решение проблемы повышения эффективности лечения онкологических больных путем разработки и внедрения в клиническую практику новых способов лучевой терапии" группа профессоров: Муравская Г.В., Вишневская Г.В., Крутилина Н.И., Морозкина Т.С., Суколинский В.Н., Тарутин И.Г. удостоены Государственной Премии Республики Беларусь в области науки и техники.
Пятый этап (2005 г. – по настоящее время) – развитие прецизионной, в том числе стереотаксической, лучевой терапии.
В настоящее время современная лучевая терапия представляет собой высокотехнологический процесс, в котором используется большой набор сложных электрофизических установок, мощных компьютерных станций и прецизионных дозиметрических приборов.
В результате разработаны и внедрены в клиническую практику:
- Метод химиолучевого лечения c использованием симультанного буста и модуляции дозы излучения при орофарингеальном раке (кандидатская диссертация Екшембеевой А.Р.).
- Метод сочетанной лучевой терапии с гипофракционированием дозы излучения у пациентов, страдающих раком предстательной железы с неблагоприятным прогнозом (докторская диссертация Демешко П.Д.).
Публикации
2015
1. Биохимический рецидив рака предстательной железы после радикальной простатэктомии
Демешко П.Д., Красный С.А.
Минск: Принтхаус, - 2015. - С. 160.
2. Лучевая терапия по поводу биохимического рецидива после радикальной простатэктомии: факторы прогноза и отдаленные результаты
Демешко П.Д.
Онкологический журнал. – 2015. – Т. 9, - № 1. – C. 56–68.
3. Сравнительный анализ отдаленных результатов радикальной простатэктомии и дистанционной лучевой терапии у пациентов, страдающих раком предстательной железы с высоким онкологическим риском
Демешко П.Д.
Онкоурология. – 2015. – № 2. – С. 61–68.
4. Сочетанная лучевая терапия с гипофракционированием дозы излучения у пациентов, страдающих раком предстательной железы с неблагоприятным прогнозом: методика проведения и непосредственные результаты
Демешко П.Д.
Онкологический журнал. – 2015. – Т. 9, - № 2. – С. 12–20.
5. Раково-специфическая выживаемость пациентов после 3D-конформной лучевой терапии по поводу рака предстательной железы в зависимости от факторов прогноза
Демешко П.Д.
Медицинская панорама. – 2015. – № 4. – С. 29–33.
6. Сравнительный анализ отдаленных результатов радикальной простатэктомии и 3D-конформной лучевой терапии при раке предстательной железы
Красный С.А., Демешко П.Д.
Здравоохранение. – 2015. – № 6. – С. 57–61.
7. High-riskprostatecancer: factors predicting biochemical recurrence after radical prostatectomy
Ulys A., Ulyte A., Dziameshka P., Sukonko O., Krasny S., Polyakov S., Smailyte G.
ActaMedicaLituanica. – 2015. – Vol. 22, - № 3. – P. 123–130.
8. Безметастатическая выживаемость у пациентов, перенесших спасительную лучевую терапию по поводу биохимического рецидива после радикальной простатэктомии
Демешко П.Д.
Онкологический журнал. – 2015. – Т. 9, - № 4. – С. 43–47.
9. Алгоритм комплексной диагностики причин биохимического рецидива рака предстательной железы после радикальной простатэктомии
Дударев В.С., Демешко П.Д., Шиманец С.В.
Онкологический журнал. – 2015. – Т. 9, - № 4. – С. 48–53.
2014
1. Отдельные результаты спасительной лучевой терапии у пациентов с биохимическим рецидивом после радикальной простатэктомии
Демешко П.Д., Красный С.А., Суслова В.А., Шалковская И.А., Ролевич А.И.
Здравоохранение. – 2014. – № 2. – С. 59–65.
2. Диагностические возможности мультипараметрической магнитно-резонансной томографии в выявлении местного рецидива рака предстательной железы после радикальной простатэктамии
Демешко П.Д.
Онкологический журнал. – 2014. – Т. 8, - № 1. – С. 51–60.
3. Роль лучевой терапии в лечении пациентов, страдающих раком предстательной железы с неблагоприятным прогнозом
Мавричев А.С., Демешко П.Д., Красный С.А., Суслова В.А.
Онкологический журнал. – 2014. – Т. 8, - № 3. – С. 73–77.
4. Radical prostatectomy vs radiotherapy in high-risk prostate cancer patients: two centre experience
Ulys A., Ulyte A., Dziameshka P., Sukonko O., Krasny S., Polyakov S., Smailyte G.
Lithuanian Surgery. – 2014. – № 4. – P. 234–243.
2013
1. Модель прогнозирования результатов остеосцинтиграфии у пациентов с биохимическим рецидивом после радикальной простатэктомии по поводу рака предстательной железы
Демешко П.Д.
Онкологический журнал. – 2013. – Т. 7, - № 2. – С. 47–52.
2. Факторы прогноза системного прогрессирования рака предстательной железы у пациентов с биохимическим рецидивом после радикальной простатэктомии
Демешко П.Д, Красный С.А.
Онкоурология. – 2013. – № 1. – С. 62–67.
3. Факторы прогноза безрецидивной выживаемости после спасительной лучевой терапии у пациентов с биохимическим рецидивом после радикальной простатэктомии
Демешко П.Д., Суконко О.Г., Красный С.А, Суслова В.А.
Онкоурология. – 2013. – № 3. – С. 64–69.
4. Прогностическая значимость оценки уровней и динамики изменения содержания простатспецифического антигена сыворотки крови у пациентов с биохимическим рецидивом после радикальной простатэктомии
Демешко П. Д.
Лабораторная диагностика. Восточная Европа. – 2013. – № 4. – С. 16–25.
2012
1. Ограничение медицинского облучения при лучевой терапии больных раком легкого
Артемова Н.А., Минайло И.И.
Чернобыльские чтения – 2012. Материалы Международной научно-практической конференции, Гомель, 19–20 апреля 2012 г. – С. 7–9.
2. Влияние стадии заболевания и степени регрессии опухоли при лучевой терапии на выживаемость больных неоперируемымэпидермоидным раком легкого
Артемова Н.А., Минайло И.И.
Материалы научно-практической конференции "УТРО". "Актуальные вопросы лучевого и комбинированного лечения онкозаболеваний и профилактика осложнений" (21–22 мая 2012 г., Харьков). Украинский радиологический журнал. – 2012. – № 2. – С. 122–124.
3. Перспективные направления в лечении высокозлокачественных глиом головного мозга
Минайло И.И., Артемова Н.А., Моисеева О.И., Лекторова Е.В.
Антиангиогенная терапия. Материалы научно-практической конференции "УТРО". "Актуальные вопросы лучевого и комбинированного лечения онкозаболеваний и профилактика осложнений" (21–22 мая 2012 г., Харьков). Украинский радиологический журнал. – 2012. – № 2. – С. 173–176.
4. Современные подходы к лечению местно-распространенного рака орофарингеальной зоны
Минайло И.И., Артемова Н.А., Моисеева О.И., Екшембеева А.Р.
Материалы научно-практической конференции "УТРО". "Актуальные вопросы лучевого и комбинированного лечения онкозаболеваний и профилактика осложнений" (21–22 мая 2012 г., Харьков). Украинский радиологический журнал. – 2012. – № 2 – С. 171–173.
5. Quality of HDR brachytherapy of favorable localized prostate cancer and number of implanted needles
Slobina E., Kozlovsky D., Soroka A., Ezhgurova Y.
RadiotherapyandOncology. – 2012.
6. Международные семинары "Физико-дозиметрические аспекты лучевой терапии злокачественных опухолей"
Тарутин И.Г., Гацкевич Г.В., Титович Е.В., Букато А.К., Дроздова М.В., Козловский Д.И.
Материалы научно-практической конференции "УТРО". "Актуальные вопросы лучевого и комбинированного лечения онкозаболеваний и профилактика осложнений" (21–22 мая 2012 г. Харьков). Украинский радиологический журнал. – 2012. – № 2. – С. 212–213.
7. О создании новых протоколов контроля качества оборудования для лучевой терапии
Тарутин И.Г., Гацкевич Г.В., Титович Е.В., Дроздова М.В.
Материалы научно-практической конференции "УТРО". "Актуальные вопросы лучевого и комбинированного лечения онкозаболеваний и профилактика осложнений" (21–22 мая 2012 г., Харьков). Украинский радиологический журнал. – 2012. – № 2. – С. 211–212.
8. Техническая и дозиметрическая поддержка методики IMRT
Титович Е.В., Тарутин И.Г., Гацкевич Г.В., Дроздова М.В.
Материалы научно-практической конференции "УТРО". "Актуальные вопросы лучевого и комбинированного лечения онкозаболеваний и профилактика осложнений" (21–22 мая 2012 г. Харьков). Украинский радиологический журнал. – 2012. – № 2. – С. 213–216.
9. Дозиметрическое обеспечение стереотаксического облучения пациентов
Гацкевич Г.В., Тарутин И.Г., Титович Е.В.
Материалы научно-практической конференции "УТРО". "Актуальные вопросы лучевого и комбинированного лечения онкозаболеваний и профилактика осложнений" (21–22 мая 2012 г., Харьков). Украинский радиологический журнал. – 2012. – № 2. – С. 146–147.
10. Дозиметрическое обеспечение стереотаксического облучения пациентов
Гацкевич Г.В., Тарутин И.Г., Титович Е.В.
Украïнский радiологичний журнал. – 2012. – № 2. – С. 146-147.
11. О создании новых протоколов контроля качества оборудования для лучевой терапии
Тарутин И.Г., Гацкевич Г.В., Титович Е.В., Дроздова М.В.
Украïнский радiологичний журнал. – 2012. – № 2. – С. 211-212.
12. Международные семинары "Физико-дозиметрические аспекты лучевой терапии злокачественных опухолей"
Тарутин И.Г., Гацкевич Г.В., Титович Е.В., Дроздова М.В., Букато А.К., Дроздова М.В., Козловский Д.И.
Украïнский радiологичний журнал. – 2012. – № 2. – С. 211-213.
13. Техническая и дозиметриическая поддержка методики IMRT
Титович Е.В., Тарутин И.Г., Гацкевич Г.В., Дроздова М.В.
Украïнский радiологичний журнал. – 2012. – № 2. – С. 213-216.
14. Мультифокальная биопсия зоны везико-уретрального анастомоза под контролем трансректального ультразвукового исследования у пациентов с биохимическим рецидивом после радикальной простатэктомии по поводу рака предстательной железы
Демешко П.Д., Карман А.В., Ролевич А.И., Красный С.А., Поляков С.Л., Богушевич Е.В., Дударев В.С.
Онкологический журнал. – 2012. – Т. 6, - № 1. – С. 52–57.
15. Роль остеосцинтиграфии в диагностике метастатического поражения костей скелета у пациентов с биохимическим рецидивом после радикальной простатэктомии по поводу рака предстательной железы
Демешко П.Д., Суконко О.Г., Красный С.А.
Онкоурология. – 2012. – № 4. – С. 70–76.
16. Роль простат-специфического антигена в прогнозировании метастатического поражения костей скелета по данным остеосцинтиграфии у пациентов с биохимическим рецидивом после радикальной простатэктомии по поводу рака предстательной железы
Демешко П.Д.
Онкологический журнал. – 2012. – Т. 6, - № 4. – С. 23–29.
17. Диагностические возможности магнитно-резонансной томографии с динамическим контрастным усилением в выявлении местного рецидива рака предстательной железы после радикальной простатэктомии
Демешко П.Д.
ARSmedica. – 2012. – № 9. – С. 70–80.

























